2023 年 6 月 28 日
质量总监 Sarah Berwouts

体外诊断 (IVD) 是医疗保健的重要组成部分,可帮助临床医生筛查、诊断、监测和治疗各种疾病。欧盟颁布的《体外诊断法规》(IVDR)旨在通过加强对 IVD 产品的评估、监管和监督要求,以改善其质量、安全性、有效性和性能,从而IVDR对临床试验有重大影响1-7。
欧盟(EU)推出的 IVDR 于 2022 年 5 月 26 日生效,取代了之前制定的体外诊断指令(IVDD)1,3。随着监管力度的加强,IVDR 对公告机构(NBs)的指定,国家主管机构和欧盟委员会的监督提出了更严格的要求1-5。因此,IVDR 可以降低欧盟各国之间解读不一致的风险,并通过上市后的可追溯性和透明度及时发现安全问题。与 IVDD 不同,IVDR 更加强调产品生命周期管理和持续产品评估。制造商有义务证明其实施了有效的质量管理体系(QMS)5。
成功的 IVD 开发需要一支知识渊博的团队。在 CellCarta,我们的专业知识能够引导 IVD 开发的全流程,提供质量和法规方面的解决方案。
IVDR 对临床试验检测有何影响?
在临床试验中,所有以医疗为目的的检测方法都被视为 IVD,并受 IVDR3 的约束。更具体地说,临床试验中用于欧洲受试者的与治疗管理决策有关的检测,包括患者选择、治疗分配和安全性监测,都属于 IVD 监管范围(图 1)。因此,在启动临床试验之前,全面了解立法要求和在研的医疗器械至关重要。专业的 IVDR知识将有助于减少性能评估首次提交后的补充需求,并降低产品撤回的风险。
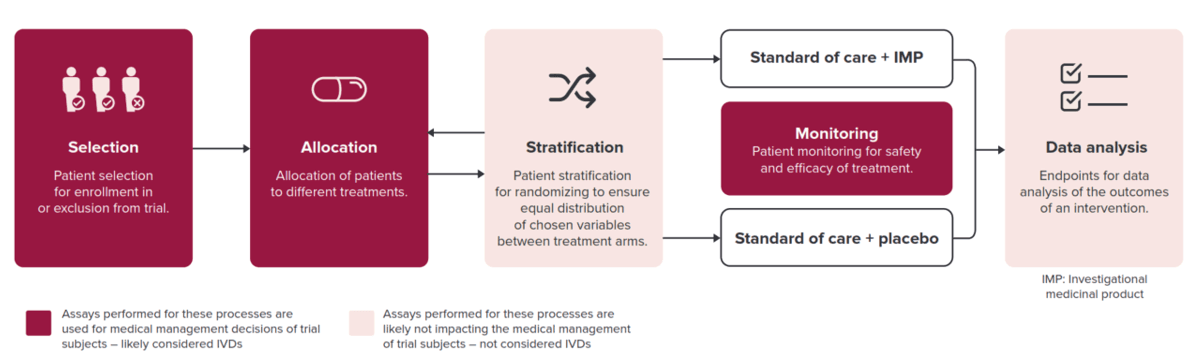
图 1. 如何确定临床检测是否属于 IVD从而需遵循 IVDR。用于探索与临床指标相关的回顾性研究中的探索性检测,不影响患者治疗决策,因此不受 IVDR管束。
从 IVDD 到 IVDR 的转变加强了对性能评估计划中有关科学有效性、分析性能和临床性能数据的审查5。IVDR 要求提供临床证据,以证明所有 IVD 器械的符合性,包括之前在 IVDD 下获得豁免的器械3-5。因此,临床试验测定需要提供更详细、更可靠的 IVD 性能数据,包括灵敏度、特异性和预测意义2,4。
此外,IVDR 引入了新的 IVD 器械分类系统,该系统考虑了与器械使用相关的风险5。一些以前被归类为低风险的 IVD 器械现在可能被归类为中风险或高风险,从而需要更广泛的临床试验数据才能获得监管部门的批准1,2,3,5。
欧洲医疗器械数据库(EUDAMED)是 IVDR 框架下 为 IVD 制定规则的一个关键方面 ,旨在提高透明度、可追溯性以及欧盟 各监管机构和经济运行之间的协调 。该数据库可在器械的整个生命周期内对其进行有效监测,加强上市后监督,提高患者安全性。
什么是伴随诊断 (CDx) 器械?
伴随诊断(CDx)器械是体外诊断器械的一个特殊类别,为安全有效地使用相应的治疗药物提供重要信息。CDx 器械被归类为 C 级,表示其有很大程度的固有风险6。在 CellCarta,我们自己专业的知识为您提供检测开发和验证方面的支持,指导您完成从临床试验分析到完全符合 IVD CDx 标准的过渡。
常见问题,专家解答!
IVDR 是否适用于美国实验室的临床试验检测?
无论实验室位于何处,只要对欧盟患者样本进行检测,均适用 IVDR。
- 当检测实验室使用内部开发的临床试验检测方法,或使用 CE-IVD 试剂盒进行标签外使用,只要检测结果是用于医疗目的,IVDR 即适用。
2022 年 5 月 26 日之前启动的临床试验是否需要根据 IVDR 提交绩效研究申请?
- 不需要,根据主管部门的反馈意见,如果该临床试验的受试者在 2022 年 5 月 26 日之前签署知情同意参与试验,则不需要根据 IVDR 提交性能能研究申请 。
临床试验中使用的所有检测方法都受要遵循IVD 法规吗?
- 不,不影响患者医疗管理决策或者患者治疗的探索性检测不受 IVDR 限制。包括分层,终点分析或其他探索性检测,比如用于探索与临床指标相关性的不影响患者治疗(医疗目的)的回顾性检测。
CellCarta 的质量保证、法规和检测开发专家团队了解 IVD CDx 开发所面临的挑战,为您提供有效的开发策略。
请联系我们,我们将指导您应对复杂的 IVDR 环境,并为您的临床试验项目提供个性化支持。
-------------------------------------------------------------------
References
- Lex – 32017R0746 – en – EUR-lex. EUR Available at: https://eur-lex.europa.eu/eli/reg/2017/746/oj. (Accessed: 26th June 2023)
- What’s changed compared to the IVDD – The European Union In Vitro Diagnostics Regulation. https://euivdr.com/whats-changed/.
- MDCG 2022-10 Q&A on the interface between Regulation (EU) 536/2014 on clinical trials for medicinal products for human use (CTR) and Regulation (EU) 2017/746 on in vitro diagnostic medical devices (IVDR). (2022).
- Dombrink, I. et al. Critical Implications of IVDR for Innovation in Diagnostics: Input From the BioMed Alliance Diagnostics Task Force. Hemasphere 6, E724 (2022).
- Factsheet for manufacturers of in vitro diagnostic. https://health.ec.europa.eu/system/files/2020-09/ivd_manufacturers_factsheet_en_0.pdf.
- Valla, V. et al. Companion Diagnostics: State of the Art and New Regulations. Biomark Insights 16, (2021).
- EUDAMED database – EUDAMED. https://ec.europa.eu/tools/eudamed/#/screen/home.

Sarah Berwouts 是 CellCarta 安特卫普分公司的质量保证总监,负责组织病理学和基因组学开发所需的 ISO 13485 质量体系的实施工作。Sarah 拥有 20 多年的专业经验,包括 8 年从事医学实验室质量体系管理工作,并负责协调欧洲囊性纤维性病化能力测试计划。此外,她还在 Multiplicom 和安捷伦科技公司的研发和质量部门担任过不同职务,在 IVD 的开发和生产方面拥有 8 年的专业经验。 Sarah 参与了 ISO 13485、ISO 15189 和 ISO 17025 质量管理体系的实施、维护和协调工作。她主修生物医学,拥有医学实验室质量改进方面的博士学位 。
